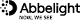製品概要|超解像度顕微鏡(単分子局在顕微鏡) SAFeシリーズ
abbelightは蛍光顕微鏡における最先端のベンチャー企業です。単分子局在化顕微鏡法(SMLM*)を応用し、15(X)×15(Y)×25(Z)nmの位置精度で観察可能です。独自のSAFe lightテクノロジーにより、広い範囲を均一に照射します。 また、複数のターゲット分子に対してマルチカラーで局在を調べられます。 さらに当メーカーはハードウェアだけでなく、測定をサポートするための光スイッチングバッファー(試薬)や解析ソフトも提供しております。
特長
- 最大視野:150×150μm2
- 位置精度:15(X)×15(Y)×25(Z)nm
- 3つの照射系:TIRF(全反射照明)、EPI(反射照明)、HiLo(薄層斜光照照明)
- 最大3色のユニークな同時マルチカラーイメージング
- 光スイッチングバッファーあり
用途・アプリケーション
- 細胞学
- 微生物学
- 免疫学
- 神経科学
- 分子生物学
- 腫瘍学
- ゲノム
- 寄生虫学
- RNAポリメラーゼの観察
- リン脂質膜、細胞膜の観察
- リポ多糖の局在
- 大腸菌の複製部位の観察
- アクチンの観察
- 細胞外小胞(EV:エクソソーム)の観察
- ウイルスの観察

*SMLMの解説
SMLMは、"Single-Molecule Localization Microscopy"の単語の頭文字をとった言葉で、単分子局在顕微鏡法を意味します。
単分子局在顕微鏡法とは、蛍光標識を一部分ずつ明滅させ、各発光点の正確な位置情報を集積することによりナノスケールの超解像度が得られるイメージング手法です。本製品 "超解像度顕微鏡(単分子局在顕微鏡) SAFeシリーズ"は、この手法が用いられています。

動画
製品紹介動画(日本語)
細胞外小胞(EV:エクソソーム)の観察
EVを3D計測
広視野でEVの局在を観察可能
EVを測定している様子(左:解析前連続撮影、右:リアルタイムSMLM解析)
SAFe360では約62,000個のEVの測定と処理が可能
Abbelight SAFe バイオイメージング プラットフォームを使用した顕微鏡から SMLM まで(約47分)
本ウェビナーの詳細はコチラをご確認ください。
測定・観察例
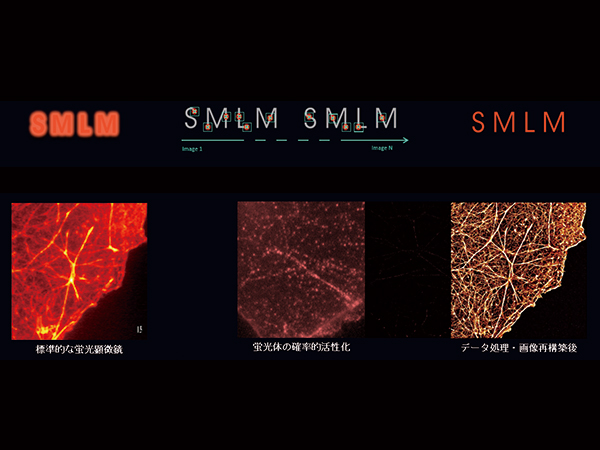
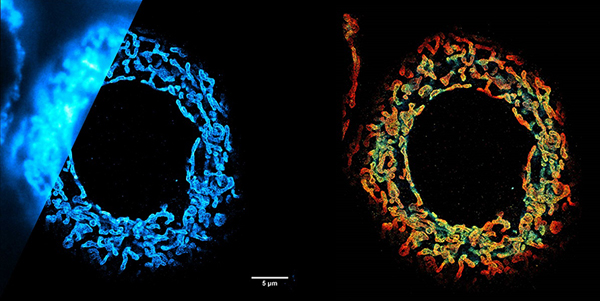
ミトコンドリアの観察
下記は、超解像度顕微鏡(単分子局在顕微鏡) SAFeシリーズ "SAFe360" で撮影されたCOS7細胞ミトコンドリアの3D-dSTORMイメージです。
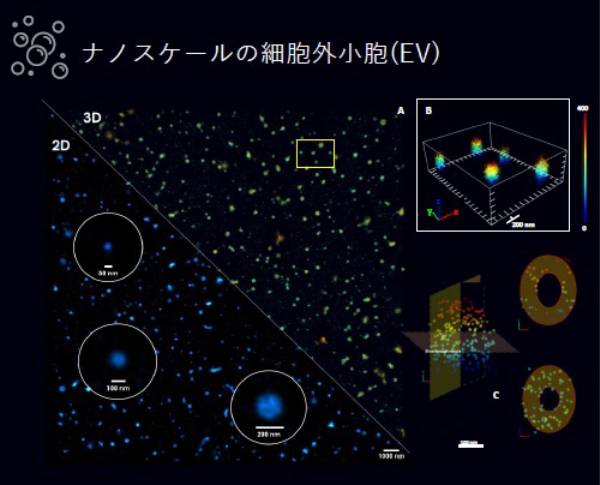
SMLMによるナノレベルの細胞外小胞の形態解析
① 細胞外小胞(EV:エクソソーム)の解析イメージです。
A:異種EVの2Dおよび3D表示。表面糖タンパクをWGAレクチンで染色しています。
B:WGAで染色した小胞の3Dでの詳細図。
C:テトラスパニンCD9に対する抗体で染色されたEV。(左側がフル3D、右側が50nm厚の矢 状面と冠状面)
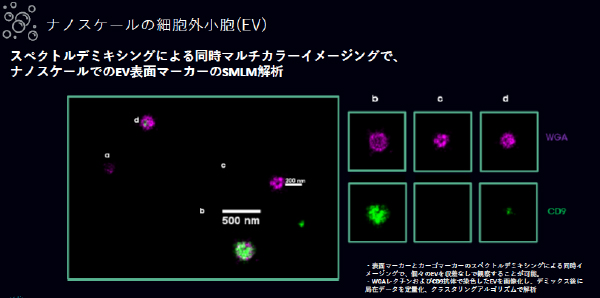
② スペクトルデミキシングによる同時マルチカラーイメージングで、ナノスケールでのEV表面 マーカーのSMLM解析の結果を示しています。
・ 表面マーカーとカーゴマーカーのスペクトルデミキシングによる同時イメージングで、個々 のEVを収差なしで観察することが可能です。
・ WGAレクチンおよびCD9抗体で染色したEVを画像化し、デミックス後に局在データを定量 化、クラスタリングアルゴリズムで解析できます。
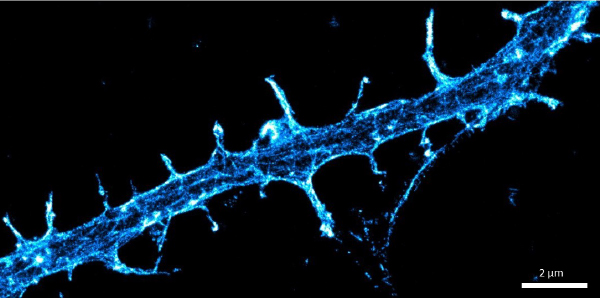
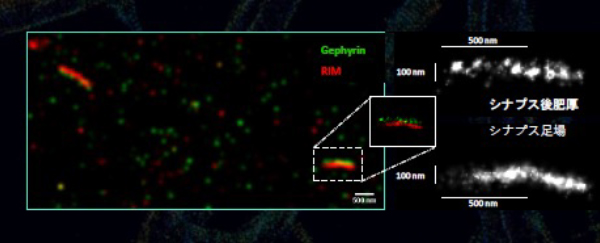
樹状突起スパインにおけるアクチン細胞骨格
1分子局在顕微鏡による樹状突起スパインのナノスケール組織化の解明が行われました。abbelightの超高速技術でイメージングによる樹状突起のアクチン細胞骨格の微細構造が分かります。これにより、シナプス可塑性に関する統計的に有意なデータを、最高の解像度と最短時間で取得することができます。
参考:Christophe Leterrier, Karoline Friedl and Florian Wernert, NeurocytoLab, INP, Univ. Aix-Marseille/CNRS
海馬初代培養における神経ネットワークの細胞骨格周期の解明
マウス海馬ニューロンを3D-dSTORMのスペクトルデミキシングによるマルチカラーで解析しています。
参考:Christophe Leterrier, Karoline Friedl and Florian Wernert, NeurocytoLab, INP, Univ. Aix-Marseille/CNRS
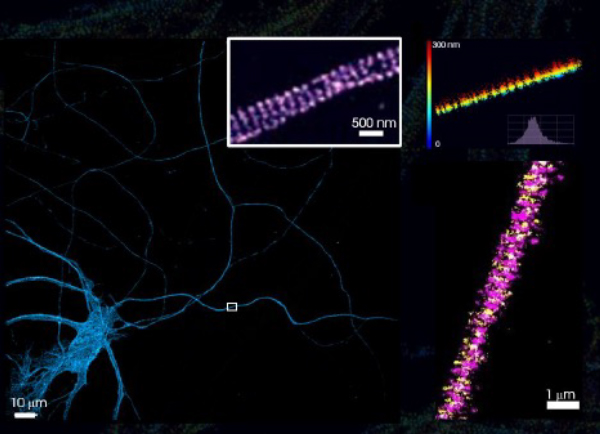
皮質ニューロンのシナプス周辺構造
マウス皮質ニューロンを2D-dSTORMのスペクトルデミキシングで解析しています。
参考:Christian Specht, ENS/INSERM
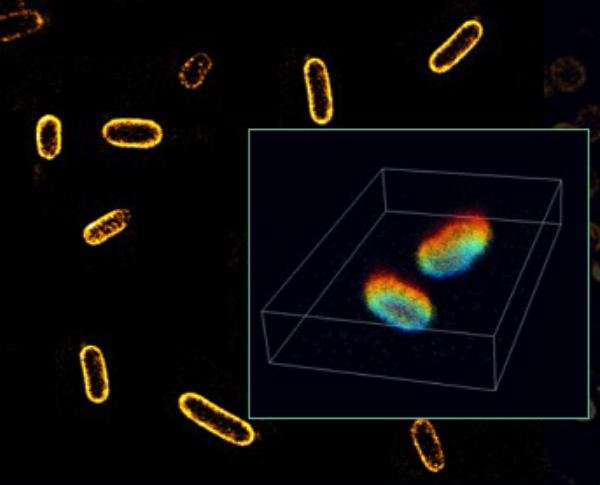
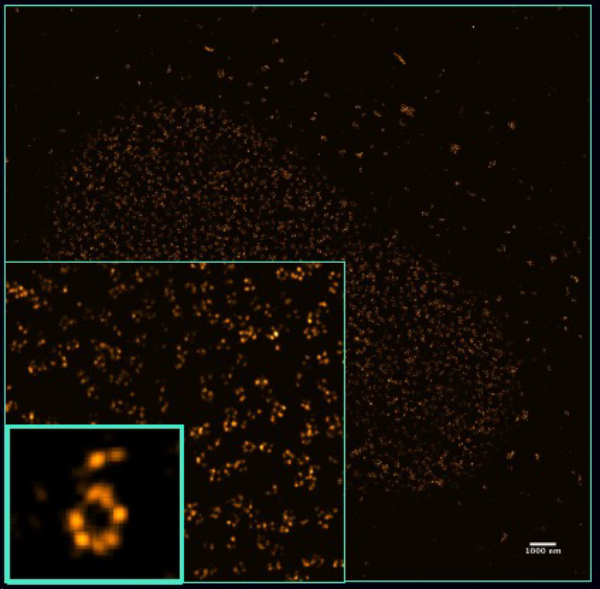
大腸菌生細胞のリポ多糖
微生物学において1分子イメージングの研究はかなりまれなものでした。しかし、その細胞内組織や薬の効果などを細かく画像化するのであれば、そのような有機体の大きさを考えると、ナノレベルの実験が非常に有効であると言えます。今回は大腸菌のリポ多糖エンベロープを標識しています。
参考:Bartosz Turkowyd & Ulrike Endesfelder, MPI, Marburg
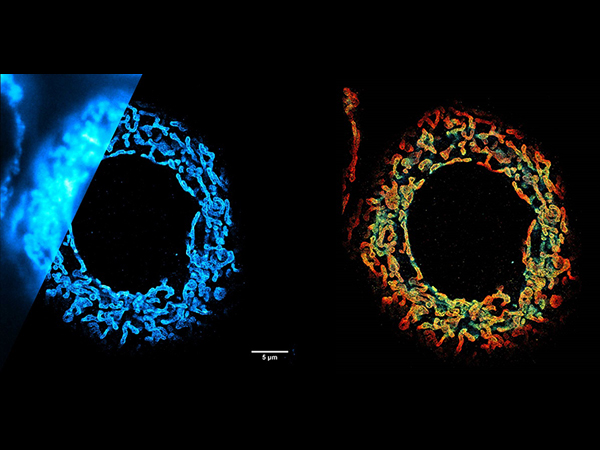
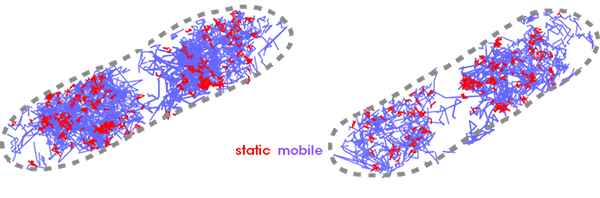
大腸菌内のRNAポリメラーゼの動きの観察(sptPALM使用)
下記は、Dendra2-RNAPを発現する大腸菌のspt(Single-particle tracking)PALMイメージングしたものです。個々のRNAポリメラーゼの挙動を追跡し、その軌道を静止(転写、赤)または移動(拡散、青)の運動タイプを色分けして表示された観測データです。
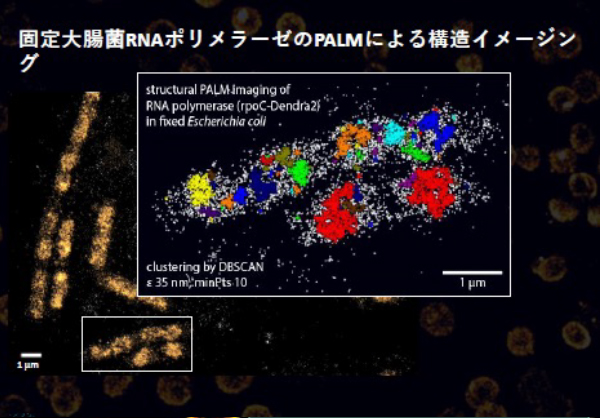
固定大腸菌RNAポリメラーゼのPALMによる構造イメージング
増殖速度の速い大腸菌の細胞では、RNAポリメラーゼ(RNAP)が大きな核様体状のパターンに空間的に組織化されており、リボソームRNA(rRNA)の活発な転写中心であることを示してます 。ここでは、PALM超解像イメージングと単一粒子追跡法(sptPALM)を用いた、大腸菌RNAPのナノスケール組織とダイナミクスの解析の様子を示しています。
参考:Bartosz Turkowyd & Ulrike Endesfelder, MPI, Marburg
中心体の構造
U2OS細胞を固定し、セントロゾームタンパクを解析しています。
参考:Karine Monier, ENS, Lyon
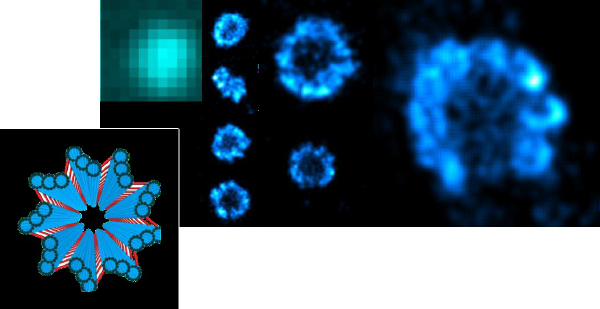
核膜孔複合体
U2OSヒト骨肉腫細胞株を使用し、NPC染色して解析しています。
参考:Mickael Lelek, Institut Pasteur
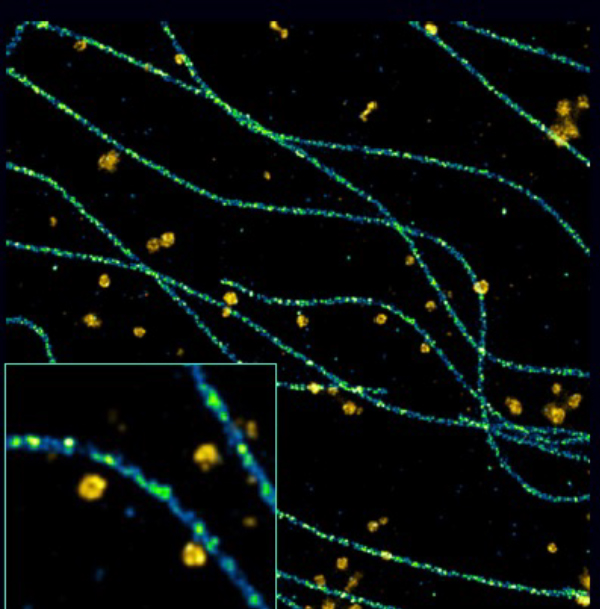
細胞骨格とエンドエキソサイトーシス
HDMEC細胞でクラスリン被覆ピットと微小管を解析しています。
参考:Haniaa Seegard , 感染症、炎症、癌における血管細胞生物学, Cochin Institute
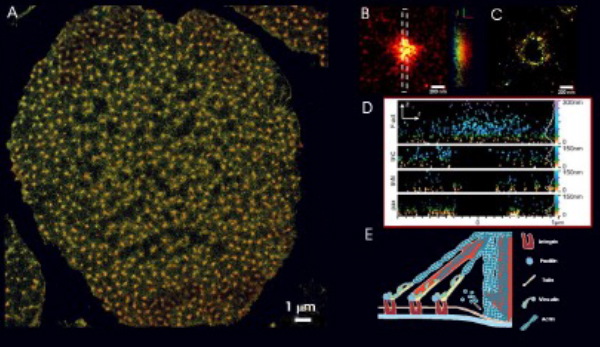
ポドソームの力発生
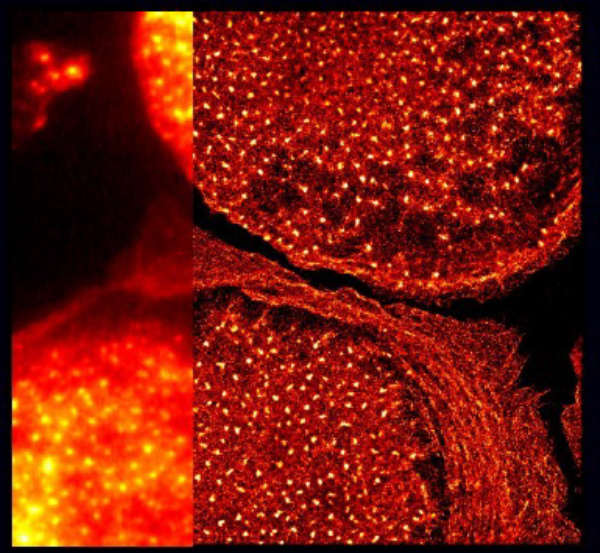
Unroofedヒトマクロファージを用いて解析しています。
参考:Renaud Poincloux, Institut de Pharmacologie et de Biologie Structurale, Université de Toulouse
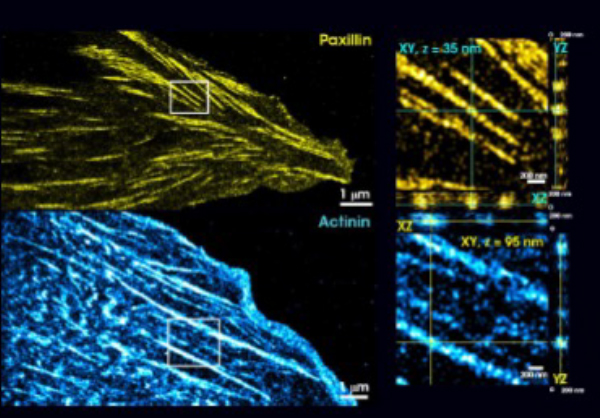
接着斑のナノスケール構造
単分子局在顕微鏡によるFanconi anemia (FA)タンパク質の空間的棲み分けの3次元的な解明
FAは数種類のタンパク質が複雑に絡み合い、厚さ200nm以下の多層プラークを形成している。絶対的な軸方向基準を持つabbelightの等方性3D解像度(15 nm)は、数十ナノメートル単位での個々のFA成分の位置特定と追跡が容易にし、その軸方向の層の状態を明らかにします。インテグリン相互作用タンパク質Paxillin(上図、黄色)は、細胞膜の直上、約35ナノメートルの高さに存在し、アクチン関連タンパク質α-Actinin(下図、シアン)は細胞膜から約95ナノメートルの位置に局在している。図では、左側に200 nmの厚さの再構成のZ投影、右側に選択した選択領域の10 nmの薄さの正距円筒図が示されています。
単分子局在顕微鏡によるリングタンパク質の組織化とポドソーム力発生機構の解明
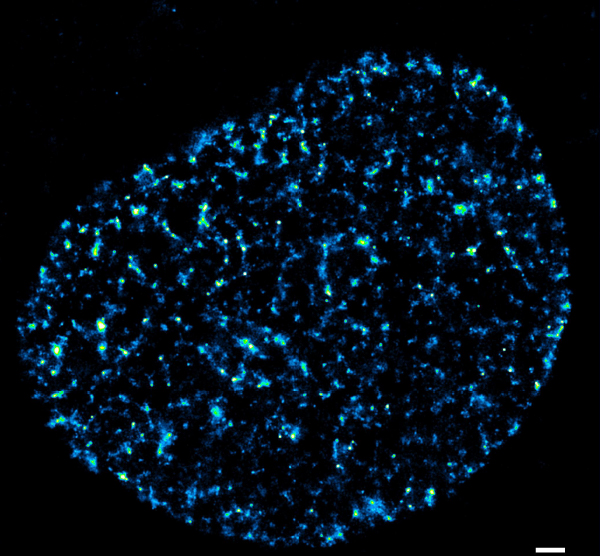
DNA複製部位
この実験では、複製部位をEdUで標識した。 EdUは、蛍光体(この場合はAlexa 647)に結合できる修飾ヌクレオチドである。細胞とEdUを30分間培養してから蛍光色素で染色したため、この画像は固定する前の30分間で複製されたDNAを表しています。EdUを入れるタイミングを変えて実験をデザインできます。これを他の色と組み合わせると、例えば複製部位にある複製因子やクロマチン因子を見ることができます
超解像度顕微鏡(単分子局在顕微鏡) SAFeシリーズ仕様
| 型名 | SAFe180 | SAFe RedSTORM | SAFe360 | |
| 超解像 イメージングモード |
PALM | ○ | - | ○ |
| STORM | ○ | ○ | ○ | |
| PAINT | ○ | - | ○ | |
| SPT | ○ | - | ○ | |
| 最大視野 | 150µm×150µm(100x) | |||
| 位置精度 | 15(X)×15(Y)×25(Z)nm3 | |||
| 照明モード(TIRF, EPI, HiLo) | ○ | |||
| 超高速SMLM | 最大値 | 800 fps(50 x 50 µm2 ) | ||
| 3D対応 | ○ | ○ | ○ | |
| マルチカラーイメージング | シーケンシャル | 同時 | シーケンシャル・ 同時 |
|
| スペクトラルデミキシング(SD) | × | ○ | ○ | |
| 更新日 | 更新内容 | サイズ | ダウンロード |
|---|